
Gli effetti secondari avversi ai farmaci sono causa di moltissimi ricoveri ospedalieri e persino di numerosi decessi l’anno in diversi Paesi. Grazie alla conoscenza del nostro DNA, che è stato possibile apprendere dal Progetto Genoma Umano, ricercatori e scienziati stanno studiando come le differenze ereditate nei geni possano influenzare la risposta dell’organismo ai farmaci. Queste differenze possono essere utilizzate per prevedere l’efficacia di un farmaco per un certo paziente e, in particolar modo, per prevenire reazioni collaterali ai farmaci.
Questo campo di studi, relativamente nuovo, combina la farmacologia (lo studio dei farmaci) e la genomica (lo studio dei geni e delle loro funzioni) e si pone l’obiettivo di sviluppare trattamenti efficaci e sicuri che utilizzino dosi basate sull’assetto genetico di quel dato paziente.
Spesso si usano i termini farmacogenetica e farmacogenomica in modo intercambiabile. La differenza tra i due è molto sottile, anche se il termine farmacogenomica indica lo studio dell’intero genoma, ovvero di tutti i geni che possono determinare la risposta alla terapia, mentre la farmacogenetica è limitata ad un numero definito di geni, noti per giocare un ruolo in determinate patologie.
POLIMORFISMI. la farmacogenomica, però, non si basa sullo studio dei singoli geni, bensì sui polimorfismi.
Sebbene il genoma degli individui sia identico per il 99,9% dei casi, esiste una differenza dello 0,1% che è in grado di dar luogo a circa 3 milioni di polimorfismi, precisamente polimorfismi a singolo nucleotide (SNP). Questi consistono in una variazione del DNA a carico di un unico nucleotide, tale per cui l’allele polimorfico risulta presente nella popolazione in una proporzione superiore all’1%.
Nei centomila o più geni appartenenti al genoma umano, i polimorfismi spesso e volentieri non causano alcun effetto.
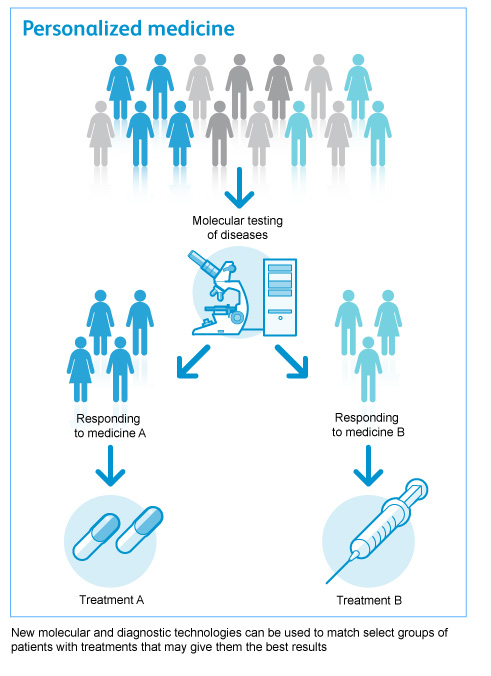 Tuttavia, le differenze genetiche influenzano il modo in cui gli individui metabolizzano i farmaci, condizionando l’espressione e la funzione delle proteine, quindi determinando se un individuo non risponderà ad un farmaco o se manifesterà una risposta clinica esagerata.
Tuttavia, le differenze genetiche influenzano il modo in cui gli individui metabolizzano i farmaci, condizionando l’espressione e la funzione delle proteine, quindi determinando se un individuo non risponderà ad un farmaco o se manifesterà una risposta clinica esagerata.
Per identificare queste varianti polimorfiche vengono usati dei Test del DNA in grado di predire, almeno in parte, quali pazienti potranno trarre beneficio da un farmaco e quali invece sperimenteranno effetti tossici. I risultati del test genetico di routine permetteranno al medico di scegliere il farmaco migliore per il trattamento di un paziente con un dato set genetico, ottimizzarne il dosaggio e ridurre il più possibile il rischio di effetti avversi.
Le terapie farmacologiche personalizzate rappresenteranno la realtà degli anni futuri, il primo passo verso terapie paziente-specifiche. I medici avranno bisogno di sapere se un farmaco è soggetto a polimorfismo genetico, che può impattare sull’espressione degli enzimi che metabolizzano il farmaco o dei recettori a cui il farmaco si lega. I primi test basati sul DNA sono già disponibili e molte aziende farmaceutiche stanno sperimentando test specifici per farmaci da poco introdotti sul mercato.
I test genetici sono entrati nella prassi ad esempio nel trattamento del carcinoma mammario metastatizzato con trastuzumab (Herceptin). In questo tipo di cancro vi è una variazione dell’espressione del gene per il recettore HER2. L’HER2 è un oncogene che se sovraespresso stimola la crescita tumorale, portando ad una prognosi infausta, che comporta aumento della formazione del tumore, metastasi e resistenza agli agenti chemioterapici. Il trastuzumab è un anticorpo monoclonale, farmaco di nuova generazione, che viene usato in questi casi come adiuvante alla chemioterapia convenzionale. Il test per l’HER2 è essenziale nell’individuare i pazienti in cui l’HER2 è sovraespresso e che quindi rispondono al trastuzumab.
Sebbene il campo della farmacogenomica sia ancora agli inizi, le più grandi opportunità di applicazione clinica provengono attualmente dai polimorfismi correlati agli enzimi che metabolizzano i farmaci.
STA EMERGENDO LA TERAPIA PAZIENTE-SPECIFICA. In futuro, nessun paziente verrà più esposto al rischio di reazioni avverse a un farmaco senza aver prima effettuato questi rapidi e semplici test del DNA. Grazie a queste procedure, sarà possibile ridurre i costi di ospedalizzazione, il numero di visite in ambulatorio e il grande spreco per terapie inefficaci.
La selezione dei pazienti che rispondono alle terapie rappresenta la soluzione più efficace ed economica al crescente problema che sta portando governi e industrie a negare farmaci efficaci a pochi perché una parte di pazienti non risponde alla cura. La politica dell’efficacia prevedibile, dei limitati effetti indesiderati, della riduzione delle complicanze grazie ad una terapia mirata, nonché un rapporto costo-efficacia favorevole dei farmaci, migliorerà i trattamenti riguardanti la salute e eliminerà il bisogno di contenimento della spesa.
L’FDA (Federal and Drug Admnistration) e l’EMA (European Medicine Agency) hanno creato commissioni regolatorie, rispettivamente in USA e Europa, per la farmacogenetica e in alcuni casi imposto l’esecuzione preventiva di test del DNA, ad esempio per alcuni tipi di cancro in cui è necessario applicare la terapia con anticorpi monoclonali.
Il campo della farmacogenomica è ancora ai suoi inizi. Il suo uso è tuttora abbastanza limitato, ma in futuro, sarà possibile sviluppare terapie “su misura” per trattare un ampio spettro di problemi di salute, incluse malattie cardiovascolari, Alzheimer, cancro, HIV/AIDS e asma.
E IN ITALIA? L’AIFA (Agenzia Italiana per il Farmaco) sta emanando direttive per l’esecuzione di test che permettono di indagare determinati geni prima della terapia con alcuni farmaci, al fine di prevederne la tossicità e/o l’efficacia. Un esempio di gene indicatore della tossicità associata all’irinotecano (uno dei farmaci più diffusi in terapia oncologica) è l’UGT1A1.
Si è osservato, infatti, che i pazienti portatori di una particolare variazione del gene UGT1A1, se sottoposti a terapia con irinotecano, vanno incontro a forme severe di tossicità. Per questo motivo la FDA ha deciso di includere nel foglietto informativo dell’irinotecano un’indicazione farmacogenetica che raccomanda un aggiustamento del dosaggio in base alla sequenza del gene UGT1A1.
In futuro, come già accade negli USA, tutti noi avremo una carta d’identità genetica, con la quale potremo accedere a cure del tutto personalizzate. La linea di partenza è segnata dai dai trattamenti oncologici, ma in futuro arriveremo ad avere farmaci da banco “su misura” per il DNA di ciascuno di noi.


