
Dopo una fase di stallo e la diminuzione degli investimenti degli anni passati, sulla terapia genica si è riaperto un grande interessamento in tutto il mondo. Oltre a riguardare le malattie genetiche rare, le sperimentazioni e i trial clinici si sono allargati a un ampio range di patologie: dai tumori alle malattie cardiache. Il merito è anche dei successi ottenuti in Italia grazie a istituzioni come Telethon e l’Istituto Tiget del San Raffaele di Milano.
Tuttavia, la terapia genica comprende anche un elenco di effetti collaterali a cui molti istituti di ricerca si stanno dedicando, per cercare di risolverli e rendere la terapia più sicura per i pazienti. Uno delle reazioni avverse e più pericolose, comuni a tutte le terapie geniche, è la risposta autoimmune, messa in atto proprio dal sistema immunitario dello stesso paziente, contro le molecole usate per veicolare la terapia. Un grande passo avanti per cercare di risolvere questo problema è stato recentemente compiuto da un team di ricercatori dell’Università di Stanford: sono infatti riusciti ad inibire le reazioni autoimmuni verso la proteina “normale”, qualora il sistema immunitario del paziente la incontra per la prima volta.
I ricercatori hanno utilizzato modelli murini (topi) affetti da distrofia muscolare di Duchenne (DMD), una patologia annoverata tra le distrofinopatie. Le distrofinopatie sono un gruppo di malattie neuromuscolari caratterizzate dall’assenza, carenza o alterazione di una proteina chiamata distrofina.
Queste condizioni portano a degenerazione del tessuto muscolare, alla progressiva perdita di forza e alla riduzione delle abilità motorie. La malattia colpisce un bambino ogni 5000 e costringe i pazienti sulla sedia a rotelle per il resto della vita, colpendoli a metà dell’adolescenza e rivelandosi fatale già prima che possano diventare adulti.
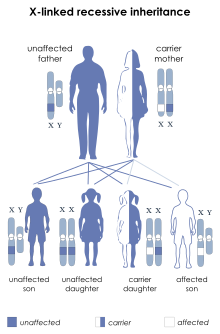
Pattern di ereditarietà della distrofia muscolare di Duchenne.
Cos’è la distrofia di Duchenne. Nella DMD la distrofina è assente del tutto e i primi sintomi si manifestano, di solito, tra i 2 e i 6 anni di età. I bambini colpiti spesso imparano a camminare in ritardo, mostrano un’andatura tipica (anserina), tendendo a camminare sulle punte, hanno problemi ad alzarsi da terra, a saltare, a fare le scale. L’ipertrofia dei polpacci è un segno tipico della malattia. Man mano che progredisce, compaiono grave scoliosi, perdita della capacità di deambulazione entro i 12 anni e successivamente i pazienti perdono la funzione degli arti superiori. Sono coinvolti anche i muscoli respiratori e cardiaci e sono proprio queste complicanze a ridurre in modo significativo l’aspettativa di vita dei pazienti. In alcuni casi può esserci un deficit cognitivo, da lieve a grave.
A livello genetico, è causata dall’alterazione del gene codificante per la distrofina, localizzato sul cromosoma X: a seconda del tipo di alterazione si potrà avere la forma di Duchenne oppure una forma differente, detta distrofia di Becker. E’ una malattia legata all’X: vene trasmessa in genere solo ai maschi (che possiedono un solo cromosoma X) mentre le femmine, a parte eccezioni, risultano essere portatrici sane (perché possiedono un altro cromosoma X oltre a quello mutato, che può compensarne le funzioni). Le stime indicano che circa due volte su tre la mamma di un bambino affetto da distrofinopatia è portatrice sana.
Al momento non esiste una terapia definitiva per la malattia. La qualità di vita dei pazienti può notevolmente migliorare con trattamenti sintomatici e pluridisciplinari (fisioterapia, valutazione della funzionalità cardiaca e respiratoria ecc.) che gestiscano i vasi aspetti della malattia: motorio, respiratorio e cardiaco. La somministrazione di steroidi può aiutare a stabilizzare le abilità motorie.
La terapia genica. Questo tipo di terapia si è rivelata ottima per trattare patologie causate da un singolo gene. La Distrofia di Duchenne deriva da un singolo gene difettoso, che la rende un candidato eccellete per la terapia genica, per cui il team di Stanford si è posto il problema fondamentale della reazione del sistema immunitario del paziente sottoposto a questo trattamento. Infatti, se si somministra una proteina “normale” a qualcuno con un gene difettoso, il cui corpo non ha mai prodotto quella proteina prima, il suo sistema immunitario reagirà (in alcuni casi, in maniera letale) così come farebbe contro qualunque proteina estranea. Il team, guidato da Lawrence Steinman, professore di neurologia e scienze neurologiche e pediatriche a Stanford, ritiene di aver risolto questo problema.
Le scoperte sono state descritte in uno studio pubblicato online su Proceedings of the National Academy of Sciences.
Il gene non funzionante, in questa terapia, viene rimpiazzato dalla sua versione corretta. La procedura consiste nell’utilizzare un vettore virale, geneticamente modificato per contenere la copia funzionante del gene in questione. I vettori vengono modificati eliminando geni non voluti dal genoma virale, conservando però quelli necessari all’infettività e aggiungendo il gene terapeutico, che deve essere “consegnato” al paziente.
Il gene codificante la distrofina è troppo grande per essere trasportato dai vettori virali che vengono di norma utilizzati per la terapia genica. Fortunatamente, però, gli scienziati hanno scoperto che è sufficiente una piccola sequenza di un intero gene per generare una versione funzionante della proteina, quest’ultima chiamata microdistrofina. La versione ridotta si adatta perfettamente all’interno del vettore virale, progettato da Jeffrey Chamberlain, PhD, co-autore dello studio e professore di neurologia, medicina e biochimica all’Università di Washington.
Indurre la tolleranza. Per aggirare il problema dell’autoimmunità, Steinman e colleghi hanno ibridato il gene per la microdistrofina in un altro tipo di vettore, detto plasmide.
Un plasmide è un piccolo anello di DNA che i batteri utilizzano per diffondere tratti importanti, uno fra tutti l’antibiotico-resistenza. Invece di utilizzare un plasmide contenente diverse corte sequenze di DNA (o motifs) che il sistema immunitario potrebbe riconoscere come sospette (e conseguentemente organizzare una forte risposta contro di esse) il team di Stanford ha capito come rimpiazzare quelle sequenze, che causavano problemi, con un altro set di sequenze di DNA che, invece di esacerbare la risposta immunitaria, la inibiscono. Questa tolleranza immunitaria indotta dal plasmide è stata impiegata in trial clinici già per due condizioni autoimmuni, con risultati promettenti.
Per il nuovo studio, i ricercatori hanno utilizzato un vettore virale del gene della microdistrofina, cui ha fatto seguito una induzione plasmide-assistita di tolleranza alla microdistrofina. Lo studio è stato fatto sui topi per contrastare il problema dell’autoimmunità.
La sperimentazione. A 15 topi di sei settimane (più o meno l’età di un bambino), ingegnerizzati affinché non esprimessero il gene della distrofina, è stato iniettato il virus “carrier” della microdistrofina. Una settimana dopo è iniziato il trial clinico, i soggetti dello studio sono stati divisi in tre gruppi a cui è stato somministrato, per 32 settimane:
- una soluzione placebo;
- una soluzione placebo con il plasmide modificato per indurre la tolleranza immunitaria ma senza il gene della microdistrofina;
- il plasmide in associazione con il gene della microdistrofina.
Alla fine del periodo di 32 settimane (a questo punto i topi avevano raggiunto lo stadio di giovane adulto) è emerso che nei soggetti che avevano ricevuto il plasmide caricato con la microdistrofina, la forza muscolare risultava notevolmente incrementata e la produzione di fibre muscolari producenti distrofina era aumentata. Inoltre, questi soggetti test presentavano livelli più bassi di segnali chimici trasportati dal sangue che veicolano messaggi infiammatori tra cellule del sistema immunitario e avevano una risposta anticorpale indebolita verso le porzioni di microdistrofina che erano solite scatenare la reazione immunitaria.
Anche se lo studio è solo agli inizi e non è ancora stato sperimentato sugli umani, il team di Steinman si dice fiducioso di poter indurre la tolleranza immunitaria in un ampio assortimento di proteine precedentemente immunogeniche, semplicemente inserendo il gene per la proteina d’interesse nel plasmide. Ciò è stato già fatto con il precursore dell’insulina per il diabete di tipo I e con la mielina in pazienti affetti da sclerosi multipla. Sembra adesso che il concetto possa essere esteso anche alla terapia genica.


